生物类似药出海美国,迎来拐点 | 见智研究
2023年,中国医药行业在海外市场的发展迎来新的里程碑。继传奇生物和百济神州成功出海后,经过两年的相对沉寂,到了2023年下半年,君实生物、和黄医药、亿帆医药的产品接连获得美国食品药品监督管理局(FDA)的批准。这一系列创新产品获批,开启了中国医药出海的新时期。
中国医药出海的步伐不仅限于创新药,生物类似药也正在展现其独特的国际化路径。
百奥泰的托珠单抗生物类似药施瑞立在10月下旬获得美国FDA的批准,根据授权方Biogen披露,围绕托珠单抗的专利纠纷日前已取得和解,该药将于24年5月在美国市场正式开售。这标志着中国生物类似药首次正式进入美国市场。
全球范围内,多款重磅生物药品的专利即将到期,这为生物类似药的快速发展提供了机遇。当下,欧美医药行业正在迎来生物类似药的新一轮高速发展浪潮。
什么是生物类似药?
生物类似药(Biosimilar)是指一种与已经批准上市的原研药生物制剂在质量、安全性和疗效上高度相似的生物制品。这类药物不是通用的仿制药,因为它们复制的原研生物药物(如蛋白质、抗体等)的复杂性和生产过程的特殊性使得完全相同的复制几乎不可能。
因此,此类药品在规范市场中推出,通常需经过严格的比较研究,以确保与原研药物在结构、效能、安全性和免疫原性等方面具有高度相似性,也因此被称为类似药。
相较原研药,2021年欧洲市场上,生物类似药的使用带来了超过50亿欧元的成本节省。而同年的美国市场,生物类似药使用则带来超过100亿美元的节省。生物类似药在欧美加总占据90%的市场份额,是我国生物类似药出海的核心目标市场。
相比于小分子化药,生物类似药有着更长的研发周期和资金壁垒。
生物类似药的开发和上市过程确实面临着较高的壁垒,主要表现在两个方面:
1)更长的上市周期:由于需要进行大型的三期临床实验并提供充分的数据来证明其与原研药品的相似性,生物类似药的研发到获批上市过程通常需要3年以上的时间。
这一周期明显长于小分子仿制药,增加了研发的复杂性和不确定性。
2)更大的投资规模:生物类似药的单个产品研发投入通常超过1亿美元。例如,复宏汉霖的曲妥珠单抗的研发投入就超过了8.5亿元人民币。
这种高额投资需求提高了参与生物类似药行业的门槛,限制了能够进入该领域的公司数量。
美国生物类似药市场成长性高
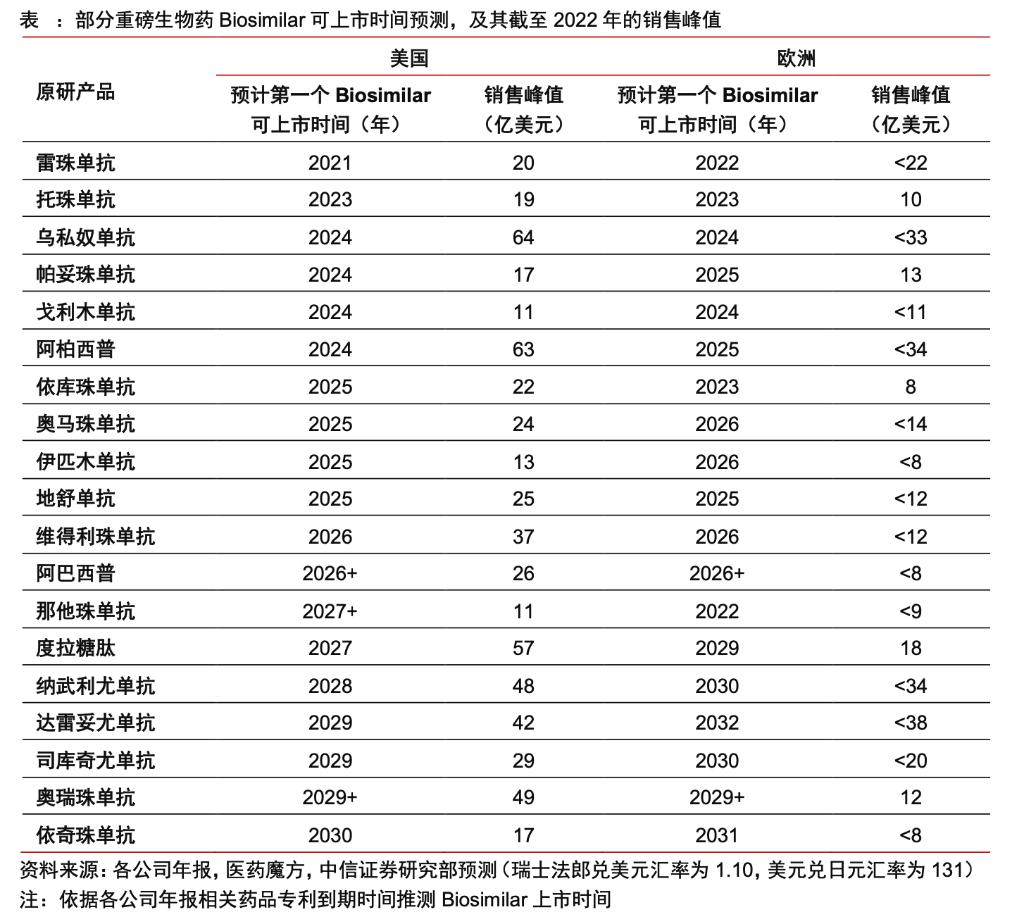
根据IQVIA预测,从2013年到2027年,生物类似药物在全球市场销售额从2013年的几乎为0增长到2027年的预测值介于20亿至49亿美元之间,表明生物类似药物市场正在快速增长。特别在2019年后增速大幅提升。
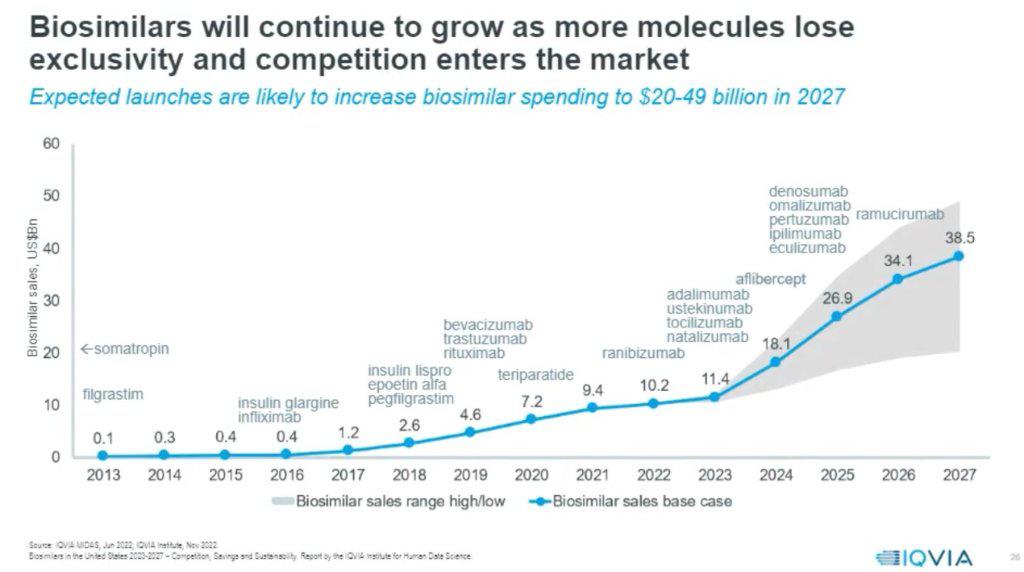
其中在,过了专利期的知名药物,如bevacizumab(贝伐珠单抗)和trastuzumab(曲妥珠单抗)的生物类似药版本显著推动了销售额的增长。
到2027年,预计ramucirumab(雷莫芦单抗)、denosumab(地舒单抗)、omalizumab(奥马珠单抗)、pertuzumab(帕妥珠单抗)、ipilimumab(伊匹木单抗)、eculizumab(依库珠单抗)等药物都将处于专利悬崖,其生物类似药将贡献显著的市场份额。
为何出海模式主要是license out?
美国药品流通体系复杂,PBM在其中扮演着重要角色。它们主要负责设计和管理处方药福利计划,它的主要客户包括医疗保险公司、雇主、以及其他医疗保险计划。
以下是PBM的几个主要运作方式:
-
药品采购和定价谈判:
PBM与药品制造商进行大宗采购谈判,争取药品价格折扣和回扣。这些谈判基于其代表的会员数量以及药品的市场需求。
- 制定福利计划:
PBM为客户制定包括哪些药品在内的福利计划。它们通常会建立一个药品清单(Formulary),这个清单决定了哪些药品会被保险计划覆盖以及患者需要支付多少自付费用。
- 药房网络管理:
PBM建立和管理药房网络,协议规定了哪些药房可提供处方药服务给其会员。它们也可能与药房协商价格,以便在网络内提供更优惠的条件。
- 处理处方药索赔:
当患者在药房购药时,PBM处理药品费用的报销。它们会审核和处理索赔,确保药品使用的合理性,并管理支付给药房的费用。
- 药品使用审查和管理:
PBM进行药物治疗管理(Medication Therapy Management, MTM),旨在确保患者得到适当的药物治疗,避免不必要的药品使用和药物相互作用。
- 患者支持服务:
提供给会员的额外服务,例如专线咨询、药物管理计划、疾病管理计划等,以提高治疗效果和药品合理使用。
因此,拥有审核医生处方、制定处方集、药物价格谈判这些核心权力,让PBM在减少药品成本和提高医疗保健效率方面扮演着重要角色。数据显示,美国前三大药品福利管理公司控制着美国85%的处方药销售。
所以,对于美国医药支付体系,整个回扣和折扣成本大头都在PBM(药品福利管理公司)方,渠道折扣可以忽略不计。因此,PBM(药品福利管理公司)对药企最终价格有决定性影响。
医药公司的遇到的产品价格主要有两类,在终端零售的价格叫List price,也就是终端上市价格。以艾伯维旗下的药王修美乐为例,修美乐当前List price为7000美元。
但这个价格并不能等同于艾伯维的零售收入。艾伯维需要向付款人(保险)、PBM(药品福利管理公司)、美国政府和其他供应链实体(批发、分销商)支付回购和折扣。除去这部分成本之后,剩余金额才会进入艾伯维口袋,而这个剩余价格就叫作Net price(净价格)。
因此Net price=List price-流通-回扣,由于流通成本较低,因此可以近似看作Net price=List price-回扣,这样再乘以用量就是厂商的毛利(Net sales)。
美国市场中间商回扣仍然是吃掉价格大头的部分,简单讲就是用高售价、高回扣来促进更多人加入保险市场。
以去年的药王修美乐为例,目前阿达木单抗类似药一共有9款产品(高低价版本算一个商品),其中有趣的是,高价版本终端定价(List price)均为修美乐的95%左右。
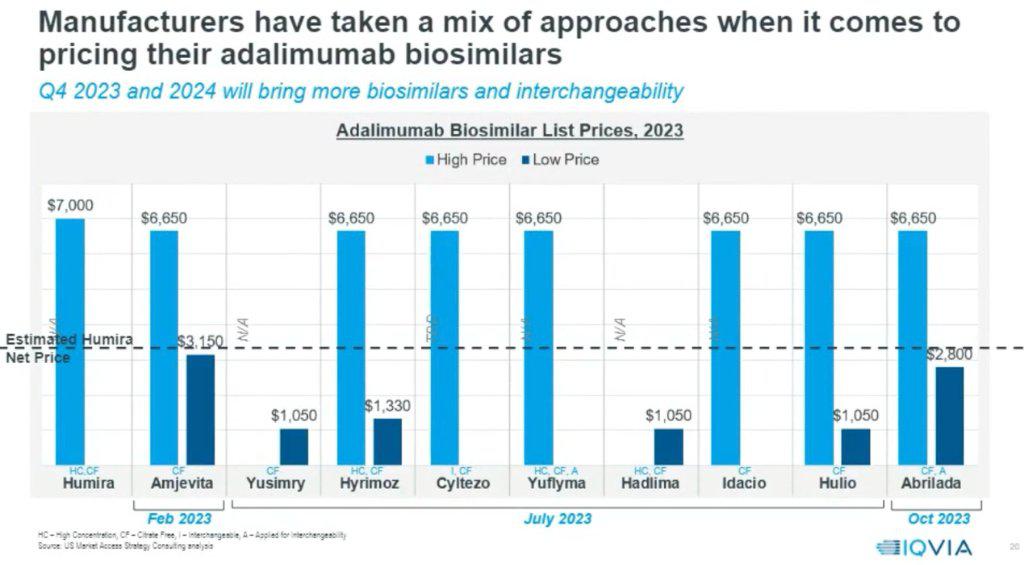
根据IQVIA的预测,修美乐的Net Price价格大致在3200美元,这意味着PBM回扣大致在3800美金,比例约为终端价格的54%。考虑到转换成本,则意味着类似药们高价版将采用更高比例的回扣来抢夺市场份额。
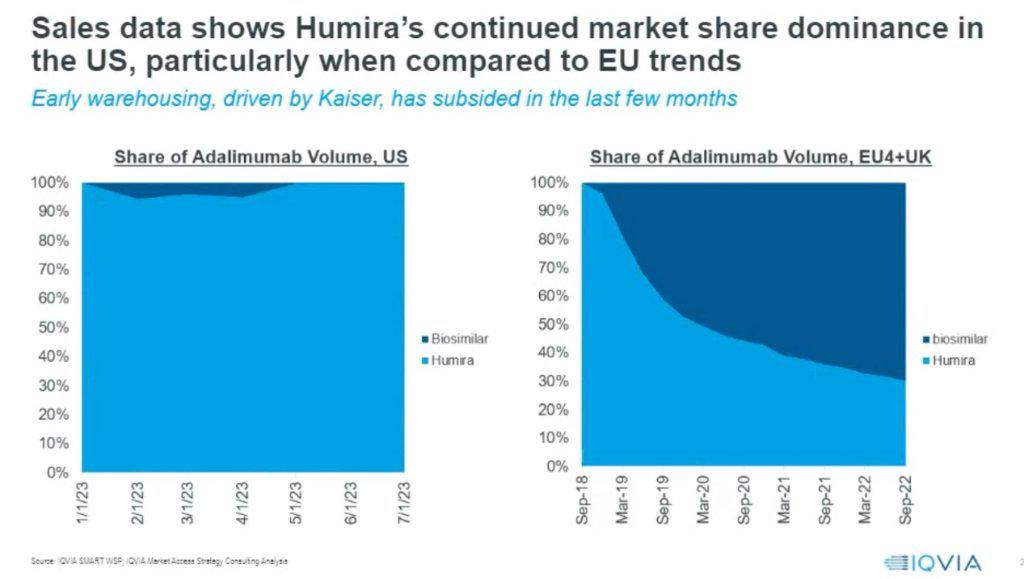
与市场大多数人直觉相反的是,修美乐在美国的市占率并没有在类似药出现后出现大幅下降,反而还在3季度初期有所上升。
由于Kaiser这样的大型医疗保健提供者的采购策略,一度推动了修美乐生物类似药的销售量,但这种趋势在2季度后有所放缓。
根据艾伯维2023年三季报,修美乐前三季度销售额仅有111亿美元,同比下降29.1%,该公司称在大约10个生物仿制药进入市场的情况下,可维持下降水平在预测范围内。
根据IQVIA的说法,到2023年年中,市场几乎没有采用第一个获批的修美乐类似药——安进的Amjevita。修美乐在美国市场的占有率又恢复上升。相信这一变化跟艾伯维采取更多的PBM回扣比例有关。
见智研究曾在文章《药王之争:便宜20%,礼来T药对司美发起价格战?| 见智研究》中介绍,PBM拥有处方建议权,而这一权力决定了它会从自身和支付方角度出发获取最大利益。
在美国医保市场,药品的市场占有率和回扣之间存在复杂的关系。有时,市场占有率较高的产品能够提供更大的回扣比例,这在理论上可以降低整个用药市场的成本。
但是,这些回扣比例通常是PBM协商决定的,且往往不对外公布,使得具体的费用计算变得复杂且不透明。
这种“黑箱”操作使得医保市场的费用计算变得困难,增加了医疗系统的复杂性。这种不透明性可能导致无法有效评估药品成本和最终对患者的费用影响,从而影响医疗系统的整体效率和公平。
不过日前美国参议院已经通过一项法案,要求PBM公布回扣比例并要求回扣全部返还支付方(保险),如果此法案实施,后续美国医药市场的定价将会有新的变化。
因此,国内生物类似药厂商选择license out模式出海更符合自身利益,其中节省了最麻烦的销售环节。不仅生物类似药,创新药也面临相近的PBM问题。
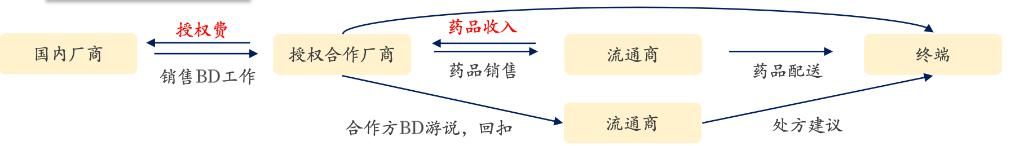
对于license out模式下的收入问题,需要注意的问题就落在中国厂商收入确认方法:
确认收入=首付款+里程碑费用+销售分成(特许权使用费)
Net Price(净价格)=终端价格(List price)-回扣-物流费用
License out厂商销售分成=Net Price(净价格)*销量*分成比例=Net Sales *分成比例。
特别地,销售分成基数是使用净价格而不是终端价格,这意味着回扣比例将大幅影响销售分成数额。
对中国生物类似药厂商来说,选择授权给美国大型药品制造商进入美国市场的好处,是节省了搞定PBM和流通等其他环节的各项沟通。节省销售团队建设,效率更高。
“一揽子”布局生物类似药更有利于出海获利
生物类似药的开发策略中,构建一个全方位、时间排序明确的“一揽子”产品管线具有显著优势。
一方面,通过已上市的生物类似药品生成的收入可以帮助覆盖新产品的临床试验费用。这样的策略不仅能保持公司的良好盈利状态,还能确保稳定的现金流,从而支持更多产品的研发和临床试验。
另一方面,有序的产品管线可以平衡药品开发过程中的各种风险,尤其是开发受挫和上市速度的不确定性。这样的策略可以保证公司在一个产品遇到挑战或延误时,仍有其他产品在不同开发阶段推进,从而维持整体的发展势头和市场竞争力。
这种系统化的产品开发和推广策略可以同时为投资者提供更稳定、可预测的投资回报。
在生物类似药领域,能够覆盖广泛的品类并与公司自身的创新药开发管线产生出协同效应,将有效降低开发和生产成本。
在中国,百奥泰和复宏汉霖是在生物类似药出海布局方面做得比较完善且领先的上市公司。
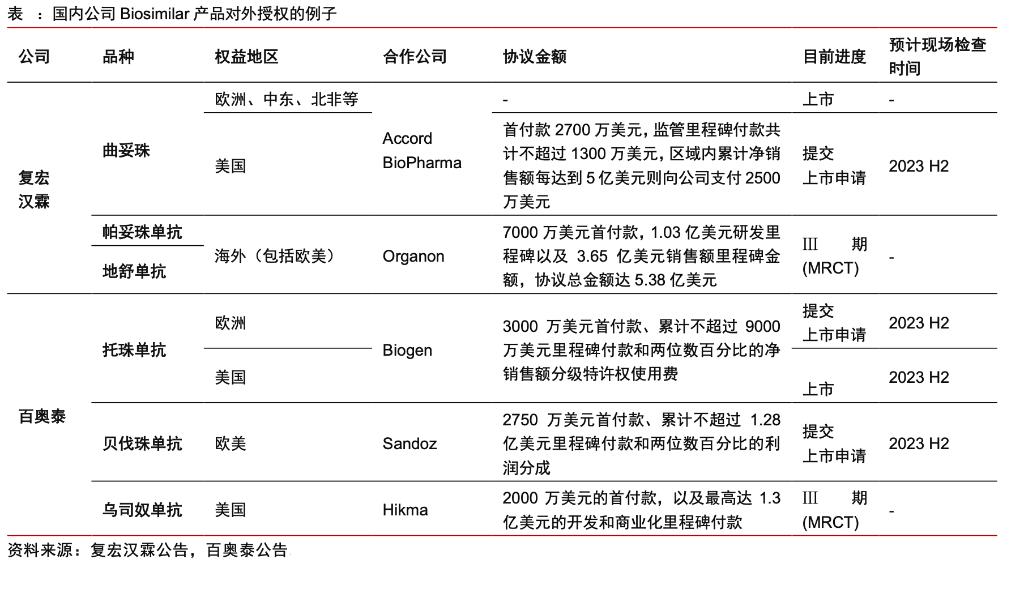
百奥泰已拥有中国第一个获得美国FDA批准的托珠单抗生物类似药施瑞立,目前授权给渤健代为销售。根据Biogen与罗氏的专利和解协议,施瑞立将于24年5月正式在美国市场销售。此外,公司的贝伐珠单抗类似药普贝希也有望在今年内获得美国FDA批准。
百奥泰主要生物类似药管线及授权情况:
- 施瑞立(BAT1806,托珠单抗):海外权益授权给了渤健。向欧洲药品管理局(EMA)提交了上市申请,并已获得美国FDA批准上市。国内已上市。
- BAT2206(乌司奴单抗):美国的权益授权Hikma公司。Hikma是一家全球性的药品公司,专注于开发、生产和销售仿制药和品牌药。3期临床已结束。
- 普贝希(BAT1706,贝伐珠单抗):有望年底在美国获批。美国、欧洲、加拿大和大多数其他未覆盖国际市场的商业化权益授权给了Sandoz。Sandoz是诺华集团专注于仿制药和生物类似药的开发和生产的公司。其余地区授权百济神州。国内已上市。
- 格乐力(BAT1406,阿达木单抗生物类似药):国内已上市。
- BAT2306(司库奇尤单抗生物类似药):全球3期临床。
- BAT2506(戈利木单抗生物类似药):全球3期临床即将结束,是目前美国市场唯一生物类似药。
百奥泰23年前三季度实现的营业收入为4.61亿元,同比+20.76%,仍未扭亏。海外市场有望扭转亏损现状。
复宏汉霖(Henlius)是首家主要靠生物类似药盈利的港股18A公司。公司的曲妥珠单抗类似药已向美国FDA提交了上市许可申请,有望今年内获得批准,合作方为Accord BioPharma。
复宏汉霖生物类似药在2023年前三季度整体销售额达25 亿元(同比+43%)。分开来看,汉曲优(曲妥珠单抗)、汉利康(利妥昔单抗)、汉贝泰(贝伐珠单抗)和汉达远(阿达木单抗)2023年前三季度分别实现销售收入约20.14、3.85、0.81 和0.32亿元,其中汉曲优海外贡献0.7亿。
复宏汉霖主要生物类似药管线及授权情况:
- 汉曲优(曲妥珠单抗):这是一种HER2靶向的乳腺癌和胃癌治疗药物。已向美国FDA提交了上市许可申请,目前等待批准中。合作方为Accord BioPharma。
- 汉利康(利妥昔单抗),靶向CD20的非霍奇金淋巴瘤,慢性淋巴细胞白血病,类风湿关节炎药物。国内已上市。
- 汉达远(阿达木单抗),靶向TNF-α的类风湿性关节炎,强直性脊柱炎,银屑病,葡萄膜炎药物。国内已上市。
- 汉贝泰(贝伐珠单抗),靶向VEGF的转移性结直肠癌瘤,肺癌,转移性或复发性非小细胞肺癌,脚趾母细胞瘤等。国内已上市。
- HLX11(帕妥珠单抗):靶向HER2的乳腺癌新辅助药物。处于全球3期临床试验。合作方Organon。
- HLX14(地舒单抗):靶向RANKL的骨质疏松症药物。处于全球3期临床试验。合作方Organon。
- HLX05(西妥昔单抗):靶向EGFR的转移性结直肠癌,头颈部鳞状细胞癌药物。处于临床I期。
- HLX15(达雷妥尤单抗):靶向CD38的多发性骨髓瘤药物。处于临床I期。
- HLX13(伊匹木单抗):靶向CTLA-4的实体瘤药物。IND阶段。
- HLX17(帕博利珠单抗):PD-1实体瘤药物。IND阶段。
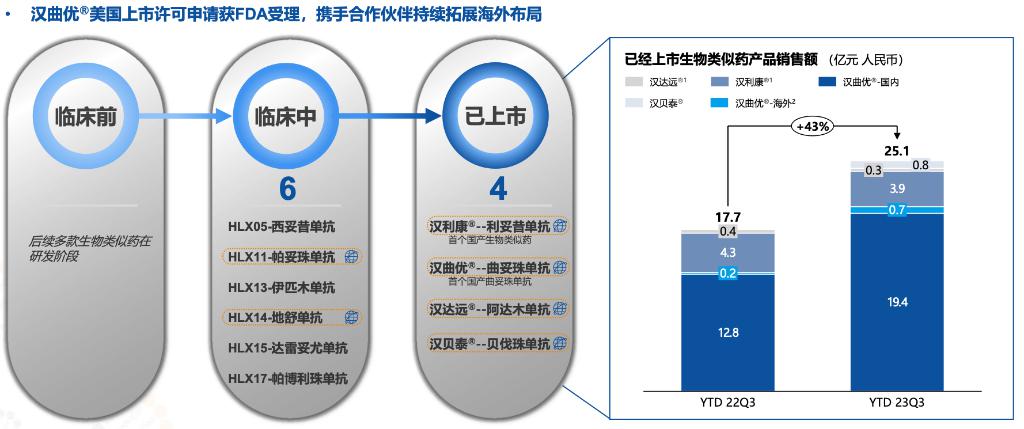
复宏汉霖最接近在美国获批的产品为汉曲优(曲妥珠单抗),根据公告,复宏汉霖松江基地一期8月接受了美国FDA针对曲妥珠单抗的上市许可前检查(Pre-License Inspection)。
随着海外市场获批,复宏汉霖业绩有望迎来新的增长点。
综上:中国生物类似药的出海正迎来转折点。未来半年,多款中国厂商的生物类似药预计将在美国获批。鉴于美国医药市场的高付费水平,这些中国生物类似药厂商有望在美国市场获得比国内更显著的经济回报。
Reprinted from 见闻VIP,the copyright all reserved by the original author.
Disclaimer: The content above represents only the views of the author or guest. It does not represent any views or positions of FOLLOWME and does not mean that FOLLOWME agrees with its statement or description, nor does it constitute any investment advice. For all actions taken by visitors based on information provided by the FOLLOWME community, the community does not assume any form of liability unless otherwise expressly promised in writing.
FOLLOWME Trading Community Website: https://www.followme.com



Hot
No comment on record. Start new comment.